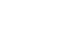肝癌是最为恶性的肿瘤之一,通常确诊时已经中晚期,以侵袭性强、死亡率高著称,位居“国内恶性肿瘤死亡榜”第二位,每年国内新发肝癌41万例。那么,肝癌为什么会有这么强的侵袭性?肿瘤细胞是如何损害正常细胞的?这都是研究者们一直关注的问题。
2023年06月19日,复旦大学附属中山医院、深圳华大生命科学研究院等机构合作在Cell Research(IF=46.3)杂志在线发表了题为“An invasive zone in human liver cancer identified by Stereo-seq promotes hepatocyte-tumor cell crosstalk, local immunosuppression and tumor progression”的研究论文,首次解析了肿瘤细胞侵袭正常肝细胞过程中的交界线周围区域的细胞组成、分子特征及交互作用,精确定义了肿瘤交界线上500μm宽的区域为肿瘤“侵袭前沿区”,在肿瘤侵袭、进展中发挥关键作用。研究还发现在肿瘤侵袭过程中,人体的正常细胞“叛变”协助了肿瘤的侵袭,组成了一个由肿瘤细胞-肝细胞-巨噬细胞三足鼎立的抑制性空间微环境。该研究基于华大智造DNBelab C4单细胞建库平台完成,揭示了肿瘤侵袭过程的细胞变化,将助力开发肝癌治疗新策略。

Cell Research官网截图
该研究基于纳米级分辨率的时空组学技术Stereo-seq绘制了原发性肝癌不同组织的单细胞和空间转录组图谱,创新性地构建了边界数字化扫描的方案来探究肿瘤侵袭边界区域的细胞构成、免疫状态特征和肿瘤细胞特征,精准定义了侵袭边界的肿瘤-正常各250μm区域是最为活跃的区域,即肿瘤“侵袭前沿区”。
在该区域内,肿瘤细胞通过表达CXCL6诱导附近正常肝细胞激活JAK-STAT3通路,进而引发正常肝细胞SAAs(SAA1/SAA2)的过表达。同时,侵袭区域的正常肝细胞SAAs的过表达和分泌会进一步招募巨噬细胞,并促进这些巨噬细胞向2型巨噬细胞(M2)转化,进而形成了局部组织的免疫抑制微环境。该研究系统揭示了肝癌侵袭前沿区域的肿瘤细胞、肝细胞和巨噬细胞三者的分布及互作关系,进而构建了局部免疫抑制性环境促进肿瘤侵袭和转移。
简单地说,就是肿瘤细胞不止会直接攻击正常细胞,还会通过损伤正常肝细胞,导致该细胞中一种基因(SAAs)的过度表达,从而招来了一种巨噬细胞,但这些本该帮助攻击肿瘤细胞的巨噬细胞,却部分转化成了协助肿瘤攻击正常细胞的免疫抑制细胞。结果,就在肝癌侵袭的前沿区域,形成了肿瘤细胞、肝细胞和巨噬细胞三者相互作用的免疫抑制环境,促进了肿瘤的发展。

肿瘤侵袭前沿区的细胞互作及促侵袭/转移机制
在发现了受损伤的正常肝细胞会产生SAAs高表达,并产生一系列的“蝴蝶效应”,最终能促进肿瘤的进展后,研究人员做了进一步的探究,发现侵袭前沿区富集的损伤状态肝细胞与原发肝癌的不良预后显著相关,类似发现在转移性肝癌中也得到了证实。
那么,是否可以通过调控SAAs的表达来影响肿瘤细胞的侵袭和转移呢?研究人员用小鼠原位肝癌和肠癌肝转移模型来进行验证。研究者用腺相关病毒在小鼠体内特异性敲减正常肝细胞的SAAs表达,结果发现可明显抑制肿瘤侵袭前沿区巨噬细胞的募集,同时原发肝癌肿瘤生长和肠癌肝转移灶也均得以延缓,这表明通过干预肝细胞SAAs的表达或可成为潜在的肝癌治疗新策略。
随着肝细胞产生的SAAs表达量的增加,生存曲线下降
“借助时空组学技术Stereo-seq,我们能以纳米级分辨率和厘米级全景视场观察肝癌的侵袭过程,”论文共同第一作者、华大生命科学研究院的吴靓副研究员表示:“研究发现了肿瘤侵袭过程中的‘内奸’——受损伤后产生SAAs高表达的正常肝细胞,可以通过免疫调节来协助肿瘤的进展和侵袭,为解析肿瘤进展机制提供了新思路。”
论文共同通讯作者、复旦大学附属中山医院周俭教授则表示:“本研究首次提出肿瘤侵袭前沿区的概念,并且精准解析和验证侵袭前沿区中局部空间微生态,为临床和病理学重新认识肿瘤侵犯前沿区、探索实体肿瘤的侵袭转移机制以及研发肿瘤治疗新策略提供新的角度和依据。”
复旦大学附属中山医院的周俭教授、杨欣荣教授,华大生命科学研究院时空组学首席科学家陈奥研究员、刘石平研究员为该论文共同通讯作者。华大生命科学研究院的吴靓副研究员、白寅琪副研究员、邹轩轩博士、许江山博士,及复旦大学附属中山医院的闫加艳博士、陈霏雨博士和黄傲主治医师为论文共同第一作者。该项目设计和实施在樊嘉院士指导下,严格遵照伦理规范开展,相关数据已完成中国人类遗传资源信息开放使用备案。
*本文部分转载自华大集团BGI

 基因测序仪业务 SEQ ALL
基因测序仪业务 SEQ ALL











 核心技术
核心技术 热门应用
热门应用 组学研究
组学研究 文档下载
文档下载 已发表文章
已发表文章 用户成功案例
用户成功案例 在线数据集
在线数据集 多功能中心
多功能中心 客户中心
客户中心 在线支持
在线支持 关于智造
关于智造 专题推荐
专题推荐