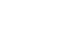2023年9月,新加坡国立癌症中心 (NCCS) 与华大智造正式宣布了战略研究合作协议。新加坡国立癌症中心基于华大智造独有的DNBSEQ核心技术开展亚洲人群中流行癌症全面、多维的基因组分析,并结合时空组学技术,正在着手肿瘤学领域全球首座DCS Lab的搭建。此次合作也是华大智造凭借其创新基因组学平台为个性化医疗和肿瘤精准诊疗提供支持的又一重要案例。
DCS Lab组学前沿实验室是华大智造于2023年9月推出的全球科研赋能项目,致力于助力全球顶级科研人员打造国际领先的、规模化、标准化的多组学前沿实验室,推动生命科学前沿研究和行业发展。该项目通过集成三种先进技术,即基因组学(DNA Omics,简称“D”)、细胞组学(Cell Omics,简称“C”)、时空组学(Spatial Omics,简称“S”),为新兴技术赋能科研加码提速。
2024年1月,新加坡国立癌症中心基于当前的DCS Lab基础平台配置及时空组学技术、单细胞测序技术,与项目合作伙伴的科研成果相继获发。
阶段性成果1
Stereo-seq助力展现肝细胞癌“癌-胚”细胞类群的空间共定位关系
肿瘤生态系统的肿瘤胚胎重编程在肿瘤微环境中诱导胚胎发育特性,导致免疫抑制微环境。新加坡国家癌症中心Pierce Kah-Hoe Chow团队联合上海市免疫学研究所Florent Ginhoux研究团队、澳大利亚科廷大学Ankur Sharma团队,使用华大智造DNBSEQ测序平台,结合时空组学技术Stereo-seq,以及scRNA-seq和bulk RNA-seq技术,系统描述了参与肝细胞癌(HCC)复发和免疫治疗反应的特定细胞亚群。他们鉴定出了POSTN+细胞外基质肿瘤相关成纤维细胞(EM CAFs)是一种关键的癌-胚相互作用中枢,促进肿瘤进展。该研究2024年1月2日发表于Nature Cancer (IF=23.177) 。文章题目:Presence of onco-fetal neighborhoods in hepatocellular carcinoma is associated with relapse and response to immunotherapy。

下图展示了该研究的研究思路。首先作者为了刻画HCC TME的全景图,利用参与了其六项研究的83名供者的251,761个细胞绘制了HCC的单细胞图谱,将其2020年发表的文章数据集的原始聚类注释投影到HCC单细胞集成簇上,结果证实其对肿瘤胚胎细胞类型分类是准确的。然后作者利用图谱中分类出来的6,163个间充质细胞进行再聚类从而鉴定出9个CAFs亚群,并详细阐述了每个亚群的基因表达特征,其中两个集成簇显示EM和粘附分子的表达显著升高,包括COL1A2、POSTN和SPP1等基因。因此,将这一亚群鉴定为EM CAFs。差异表达基因(DEG)分析显示,EM CAFs优先表达参与TGFβ反应、轴突生成和白细胞迁移的基因。
该研究通过华大智造DNBSEQ测序平台,结合时空组学技术Stereo-seq,以及单细胞RNA测序和bulk RNA测序等多种技术,结合HCC单细胞图谱,结果清楚地验证了POSTN+ CAFs是HCC中“癌-胚”生态系统的主要通信枢纽以及包括POSTN+ CAFs、FOLR2+ TAMs和PLVAP+ ECs在内的“癌-胚”细胞类型在HCC TME中时空共定位于同一个生态位,且该生态位受多个配体协同调控。更重要的是,该研究将“癌-胚”重编程的新发现与HCC患者的临床结果及其对免疫临床治疗作用的影响联系起来,为早期HCC的分层诊疗以及预测肿瘤复发提供科学的参照依据,同时也为以TME为靶向的联合免疫治疗提供了潜在的指导方案。
阶段性成果2
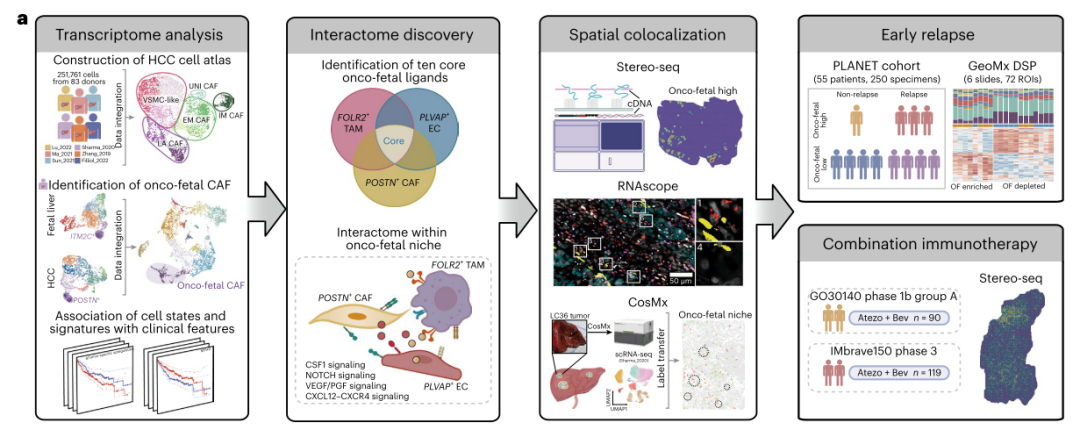
卵双胞胎罕见病例:Stereo-seq助力揭示特发性多中心Castleman病的细胞和分子机制
Castleman病是一组异质性淋巴增殖性疾病,分为单中心型(unicentric,UCD)和多中心型(multicentric,MCD)。特发性多中心Castleman病(Idiopathic Multicentric Castleman Disease,iMCD)是一种罕见的细胞因子驱动疾病,以全身炎症、全身淋巴结病和器官功能障碍为特征。
SingHealth杜克-新加坡国立大学学术医疗中心(Duke-NUS Medical School)联合新加坡国家癌症中心科研团队,采用华大智造DNBSEQ测序平台,结合时空组学技术Stereo-seq,绘制了患有罕见特发性多中心Castleman病(Idiopathic Multicentric Castleman Disease,iMCD)的同卵双胞胎病例的淋巴结单细胞空间图谱,揭示了IL-6通路信号在淋巴结内皮细胞和成纤维细胞网状细胞中的主导地位,并描述了外周血单核细胞(peripheral blood mononuclear cells,PBMC)亚群的异质性,揭示了单核细胞的宿主免疫应答表型,为未来的iMCD临床评估提供了基础。相关成果2024年1月3日发表于Blood (IF=25.669)。文章题目:Single-cell landscape of idiopathic Multicentric Castleman Disease in identical twins。

该研究描述了一对患有iMCD的双胞胎病例,提供了导致iMCD发生的可能证据。通过华大智造DNBSEQ测序平台,结合时空组学技术Stereo-seq以及结合scRNA-seq,绘制了iMCD的淋巴结单细胞空间图谱,发现IL-6通路基因与内皮细胞和成纤维细胞网状细胞显著共定位,揭示了IL-6通路信号来源于血管成纤维网状细胞和内皮细胞。同时,通过对PBMC单细胞景观的进一步分析,描述了不同单核细胞的宿主免疫应答表型,为未来的研究提供了详细的临床评估基础。以下是该文章的研究框架图:
随着科学研究的深入发展,肿瘤领域的很多研究也越来越需要同时在DNA、细胞、组织等不同维度对样本进行批量处理和成体系化的研究,包括基因组学(DNA Omics)、细胞组学(Cell Omics)和时空组学(Spatial Omics)等多学科技术的交叉应用和协同创新。DCS Lab组学前沿实验室能够为不同规模的组学研究提供强大助力,能够降低多平台集成的复杂性,兼容性高,便于快速开展新技术的转化应用,提高科研效率,助力全球科研人员产出优异的科研成果,赋能全球生命科学发展。
*本文部分转载自华大时空

 基因测序仪业务 SEQ ALL
基因测序仪业务 SEQ ALL











 核心技术
核心技术 热门应用
热门应用 组学研究
组学研究 文档下载
文档下载 已发表文章
已发表文章 用户成功案例
用户成功案例 在线数据集
在线数据集 多功能中心
多功能中心 客户中心
客户中心 在线支持
在线支持 关于智造
关于智造 专题推荐
专题推荐